セルゲル法で使用する薬剤
Discogelについて
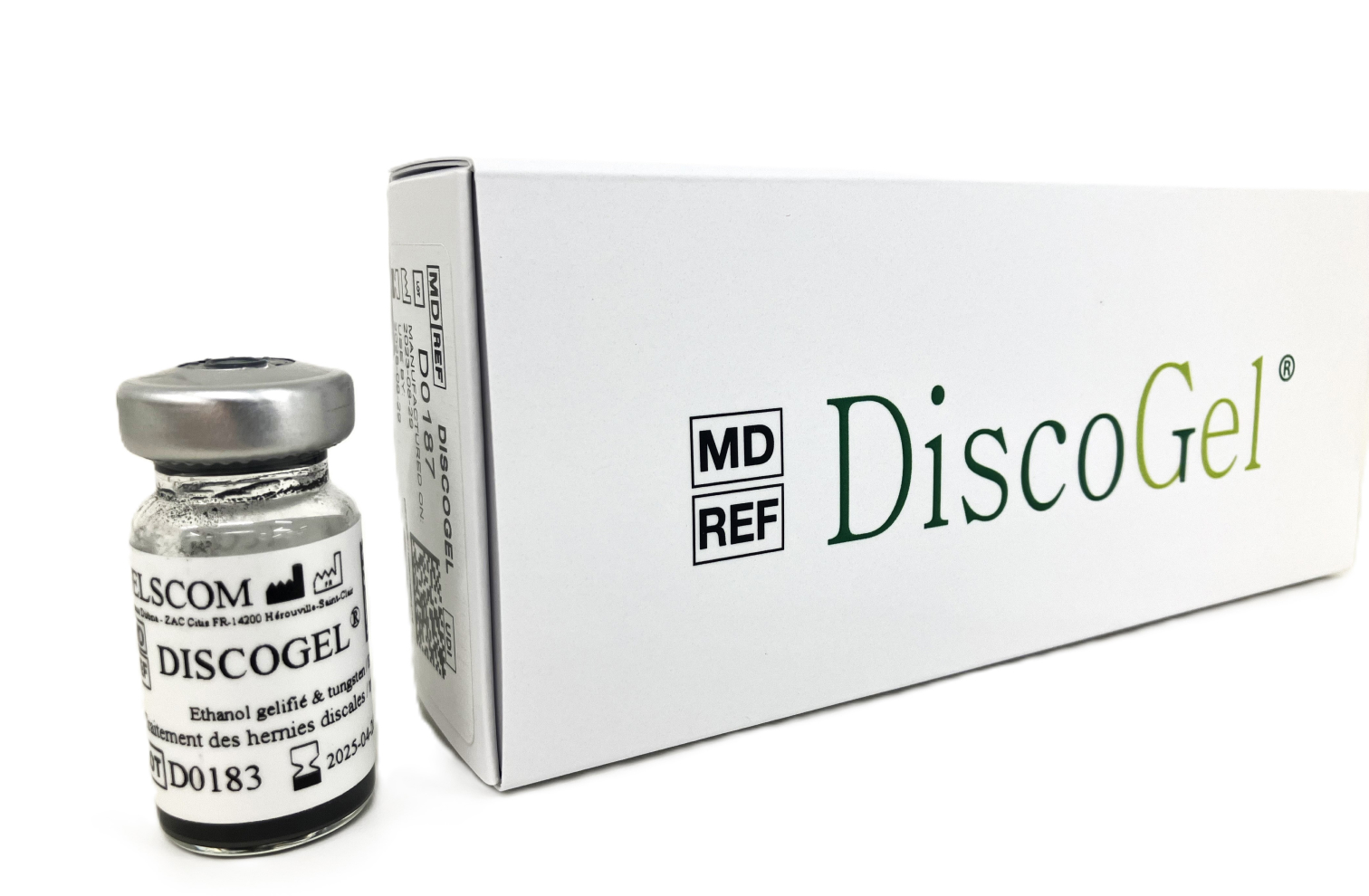
セルゲル法で使用する薬剤-DISCOGEL®とは
DISCOGEL®(「ディスコゲル」「ディスクジェル」「ディスクゲル」「ディスコジェル」)は、ゲル化したエタノールをベースに、X線に不透明なタングステン粉を添加した医療機器です。
主な原料はエチルセルロースやタングステンです。
-
- ①エチルセルロース
-
綿の種子が原料で、リップグロス、マニキュア、ボディケア製品などの化粧品や、経口剤、外用剤、歯科外用剤・口中用剤などの医薬品に利用されています。
エチルセルロースは水分を吸収し、固まるという性質をもっています。
椎間板に注入すると、飛び出て神経を圧迫していたヘルニア部分が吸収されて引き込まれます。椎間板の中でエチルセルロースが固まることで、椎間板のクッション機能を補います。
-
- ②タングステン
-
X線に反応します。そのため、治療中や治療後でも薬剤が椎間板に入っていることが確認できます。
また、タングステンは抗菌効果があり、細菌増殖を阻害し、椎間板内感染のリスクを低減できるとされています。*1*1 参照元:S.Shirzadfar, et al. Bacteriostatic and Bactericidal Effects of DISCOGEL. ACTA Scientific Microbiology, Volume 4 Issue 5, May, 2021.
DiscoGelの諸外国における安全性等にかかわる情報
CEマーキングを取得しています(認証年月日:2007年10月5日)。
CEマーキングは、製品がすべての関連する欧州医療機器規則(MDR)の安全性及び性能に関する一般要求事項(GSPR)を満たしていることを医療機器製造業者が主張するものであり、欧州連合内において機器を上市するために必要な法的要求事項です。
欧州医療機器規則(MDR: Medical Device Regulation)に準拠しています。欧州医療機器規則 Regulation (EU) 2017/745は EU における医療機器に対する要求を定めるものです。
日本においては、医薬品医療機器等法上の承認を得ていない未承認医療機器ですが、「医師等の個人輸入」により適法な輸入許可を得ています。
日本では、未承認医療機器を、医師の責任において使用することができます。
国内においては承認されている医療機器はありません。
DiscoGelの副作用等について
治療で使用する局所麻酔のお薬が注射針に沿って拡散し、一時的なしびれなどを引き起こす可能性があります。治療後1週間前後で一時的に痛みが発生する可能性があります。理論的には、治療時にDiscoGelが神経根に接触すると一過性の火傷のような感じをもたらす可能性があります。神経痛を伴う一時的な放射状の刺激が治療直後に現れる可能性があります。可能性は非常に低いですが、治療後に椎間板の容積が大きく減少した場合には腰痛が悪化する可能性があります。その他、咽頭痛、一時的な排尿障害、アレルギー反応、椎間板炎が発生する可能性があります。
DiscoGelが使用できない対象者(禁忌について)
構成成分に対するアレルギーがあることが知られている方、重度のうつ病、その他痛みの解釈が困難な状態にある方には使用できません。
また、妊娠中の方には適応していません。
※「DiscoGel」「ディスコゲル」「ディスクジェル」「ディスクゲル」「ディスコジェル」は、フランスのメーカーGelscom社及び、Gelscom社と契約している日本で唯一の会社でGelscom社の総代理店であるオペレーション・ジャパン株式会社が商標権を保有する名称です。